Desvendando a Eletronegatividade na Molécula da Vitamina C
Desvendando a Eletronegatividade na Molécula da Vitamina C
O que é vitamina C
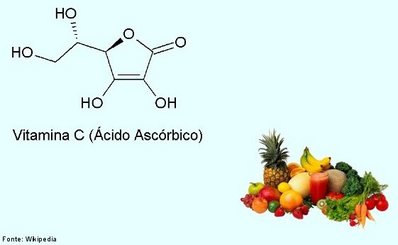 |
| formula estrutural vitamina c |
Olá! Que legal que você está explorando o mundo da química! Hoje, vamos dar uma olhada em como a eletronegatividade funciona em uma molécula um pouco mais complexa do que o sal de cozinha: a Vitamina C (ácido ascórbico).
Lembre-se, a eletronegatividade é como a "força" que um átomo tem para atrair os elétrons compartilhados em uma ligação química para mais perto de si.
A Vitamina C: Uma Molécula com Muitos Atores
A fórmula molecular da Vitamina C é C6H8O6. Isso nos diz que cada molécula dessa vitamina essencial é formada por:
- 6 átomos de carbono (C)
- 8 átomos de hidrogênio (H)
- 6 átomos de oxigênio (O)
Ao contrário do cloreto de sódio (NaCl), onde um átomo doa um elétron para o outro, na Vitamina C, as ligações entre os átomos são principalmente covalentes. Isso significa que os átomos compartilham elétrons.
O Papel da Eletronegatividade na Vitamina C
Dentro da intrincada estrutura da Vitamina C, cada tipo de átomo exerce sua "força" de eletronegatividade de maneira diferente:
- Oxigênio (O): O Átomo "Forte"
O oxigênio é altamente eletronegativo. Ele tem uma grande tendência de puxar para si os elétrons que compartilha com os átomos de carbono e hidrogênio. - Carbono (C): Uma Força Intermediária
O carbono possui uma eletronegatividade moderada, ficando em um ponto intermediário na "disputa" pelos elétrons. - Hidrogênio (H): O Menos "Forte"
O hidrogênio é o menos eletronegativo dos três. Seus elétrons compartilhados são geralmente atraídos com mais força pelos átomos de carbono ou, principalmente, pelos átomos de oxigênio aos quais ele está ligado.
As Consequências da Eletronegatividade na Molécula
A diferença de eletronegatividade entre os átomos da Vitamina C leva a algumas consequências importantes:
- Polaridade das Ligações:
Como os elétrons não são compartilhados igualmente, as ligações se tornam polarisadas.- Na ligação O-H (oxigênio-hidrogênio), o oxigênio (mais eletronegativo) atrai os elétrons, ficando com uma pequena carga negativa (δ-) e o hidrogênio com uma pequena carga positiva (δ+).
- Na ligação C-O (carbono-oxigênio), o mesmo acontece, com o oxigênio puxando os elétrons com mais força.
- Na ligação C-H (carbono-hidrogênio), a diferença de eletronegatividade é menor, resultando em uma polaridade menos significativa.
- Distribuição de Elétrons:
As regiões da molécula de Vitamina C que contêm átomos de oxigênio têm uma maior concentração de elétrons ao seu redor. As áreas com hidrogênios ligados a oxigênio têm uma menor concentração de elétrons. - Comportamento da Molécula:
Essa distribuição desigual de cargas (polaridade) influencia como a Vitamina C interage com outras substâncias, como a água. As partes "carregadas" da molécula conseguem interagir com as moléculas polares da água, o que explica por que a Vitamina C é solúvel em água.
E a Eletropositividade na Vitamina C?
Embora a Vitamina C seja caracterizada por ligações covalentes, podemos observar um aspecto da eletropositividade nos átomos de hidrogênio ligados aos oxigênios. Como o oxigênio "puxa" os elétrons com mais intensidade, os hidrogênios acabam ficando com uma pequena carga positiva (δ+), mostrando uma tendência a ter seus elétrons "afastados" deles em relação ao oxigênio. Eles são, portanto, parcialmente eletropositivos.
Entender a eletronegatividade nos ajuda a decifrar as interações dentro de moléculas complexas como a Vitamina C e a compreender suas propriedades únicas. É como entender as diferentes "personalidades" dos átomos e como elas influenciam o comportamento das substâncias que formam!
Se você tiver mais curiosidades sobre o mundo fascinante da química, continue explorando, Aqui no nosso blog.
Publicidade paga por afiliados:

Comentários
Postar um comentário